LES COMPOSES ET SOLUTIONS IONIQUES |
|
Objectifs : |
Comment associer les ions négatifs et les
ions positifs. Comprendre la règle d’électroneutralité d’un composé ionique ou d’une solution ionique |
I. LES CATIONS ET LES ANIONS MONOATOMIQUES
| Les composés ioniques( à l’état solide) et les solutions ioniques
( à l’état hydraté) comportent toujours, ensemble, des ions positifs et des ions
négatifs associés. Le nombre d’ions positifs n’est pas forcement le même que
le nombre d’ions négatifs. Tout va dépendre de la charge relative de chacun des
deux ions pour obéir à la règle d’électroneutralité de la matière ;
c’est à dire que la charge électrique portée par les uns doit être annuler par la
charge électrique des autres. ( exemple : il faut 2 ions chlorure ( Cl 1-)
pour compenser un ion Calcium (Ca2+) dans le Chlorure de Calcium de formule
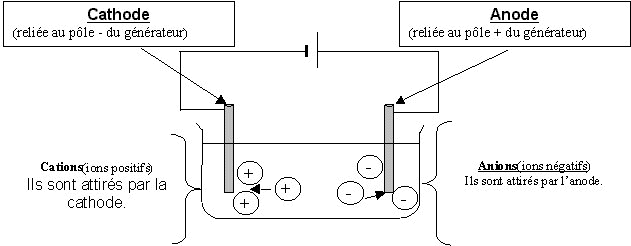
CaCl2 ). Les ions positifs sont appelés cations car ils sont attirés par la cathode lors d’une électrolyse alors que les ions négatifs appelés anions sont attirés par l’anode.
|
|
| Les cations simples Ce sont les ions positifs dont la charge (valence) peut être déterminée à l’aide de la classification des éléments. Leurs noms sont assez simples puisque ce sont les mêmes que les noms des éléments correspondants. |
Les anions simples Ce sont les ions négatifs dont la charge (valence) peut être déterminée à l’aide de la classification des éléments. Leurs noms se terminent souvent par le suffixe " ure " après le nom de l’élément, sauf quelques exceptions. |
| Li 1+ Ion Lithium | Cl 1- ion chlorure (élément Chlore) |
| Na1+ Ion Sodium | F 1- ion fluorure (élément Fluor) |
| Mg 2+ Ion Magnésium | I 1- ion iodure (élément Iode) |
| Ca2+ Ion Calcium | O 2- ion oxyde (élément Oxygène) |
| K 1+ Ion Potassium | S 2- ion sulfure (élément Soufre) |
| Al 3+ Ion Aluminium | N 3- ion Nitrure (élément Azote) |
| On rappelle que pour trouver la charge d’un cation ou d’un anion monoatomique il suffit de consulter la classification périodique des éléments . En ce qui concerne les ions métalliques(par ailleurs tous positifs), une méthode inductive permet de déterminer la valeur de leur charge dans la mesure où l’on connaît la charge de l’anion et le nombre d’ions négatifs qui les accompagnent . |
II. LES CATIONS ET LES ANIONS POLYATOMIQUES OU COMPLEXES
Les cations polyatomiques Ce sont les ions positifs formés de plusieurs atomes dont la charge (valence) est toujours la même. |
Les anions polyatomiques Ce sont les ions négatifs formés de plusieurs atomes dont la charge (valence) est toujours la même. Ce sont les plus nombreux. |
| (NH4)1+ ion ammonium | (SO4)2- ion sulfate |
| (H30) + ion hydronium | (CO3) 2- ion carbonate |
| (HCO3)1- ion hydrogénocarbonate | |
| (PO4)2- ion phosphate | |
| (NO3)1- ion nitrate | |
| (OH)1- ion hydroxyde | |
| (Cr2O7) 2- ion dichromate | |
| etc |
III. ASSOCIATIONS DE CATIONS ET D’ANIONS
| Quelques règles sont encore nécessaires ou doivent être rappelées pour permettre aux élèves de s’en sortir sans que cela soit trop théorique. |
1) Dénomination du composé
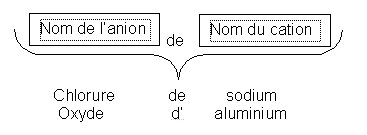
2) Formule du composé
| Attention pour la formule du composé on commence par le cation selon le schéma suivant : |

| Ce tableau permet de poser des questions dans tous les sens et donne
une vision des problèmes qui peuvent être retenus. Les deux premières lignes donnent la
façon de procéder et les liens entre les différentes colonnes. Les lignes suivantes
peuvent être remplies entièrement par les élèves en fonction des données des
colonnes. Les ions sont mis entre parenthèses pour éviter que les élèves ne changent
la charge de l’ion sauf pour les ions métalliques où ils doivent déterminer la
charge. La formule a une signification statistique : NaCl signifie que le composé contient autant d’ions (Na 1+) que d’ions ( Cl1-) alors que le chlorure d’aluminium contient 3 fois plus de ( Cl1-) que de (Al 3+). |
Nom du composé
Formule
Ions positifs
(cations)
Ions négatifs
(anions)
Chlorure de sodium
NaCl
1x (Na 1+)
1x( Cl1-)
Chlorure d’aluminium
AlCl3
1x (Al 3+)
3x(Cl 1-)
Chlorure de ……….. ………..
…x(Mg 2+)
..x (……)
…………………………
………..
2x (Fe….)
3x(SO4)2-
Sulfure de sodium
………..
..x (……)
..x (……)
…………………………
Al2O3
..x (……)
..x (……)
…………………………
………..
1x (Cu …)
2x( Cl1-)
Chlorure de calcium
………..
..x (……)
..x (……)
Hydroxyde de fer(II)
………..
1x (Fe …)
2x(OH)1-
Nitrate d’argent
Ag NO3
..x (……)
..x(NO3 )1-
Carbonate de potassium
………..
..x (……)
1x(CO3)2-
Chlorure d’ammonium
………..
..x (NH4)1+
..x (……)