Orbitales s
Couches Électroniques
À mesure que le numéro atomique augmente le nombre d'électrons augmente lui-aussi pour
l'atome neutre d'un élément. Les électrons de valence sont ceux qui sont responsables
de la réactivité chimique. Si les éléments qui ont le même nombre d'électrons de
valence sont regroupés ensembles dans un groupe ou dans une famille, c'est parce qu'ils
ont des propriétés chimiques semblables.
La première période courte (horizontalement) ne contient que deux éléments. Ces
éléments remplissent la couche K . Cette période se termine avec l'hélium qui a la
couche K remplie de ses deux électrons.
La deuxième période est courte, elle aussi. Elle ne contient que huit éléments. Elle
commence au lithium et se termine avec le néon. Le néon possède une couche L complète
avec huit électrons.
La troisième période est courte, elle aussi. Elle ne contient que huit éléments. Elle
commence au sodium et se termine avec l'argon qui possède huit électrons sur sa couche M
qui est incomplète.
La quatrième période contient dix-huit éléments. Elle commence au potassium et elle
contient une série de dix éléments qui va du scandium jusqu'au zinc. Cette série
d'éléments s'appelle série des éléments de transition.
Ils construisent la couche M du huitième au dix-huitième électrons. Avant que cette
série ne commence à se remplir, il y a deux électrons qui entrent dans la couche
intérieure N .
Après cette série de transition, la couche N continue de se remplir jusqu'à ce qu'elle
contienne ses huit électrons pour se terminer avec le krypton.
La cinquième période se remplit comme la quatrième période. Dans celle-ci la couche O
prend deux électrons et la couche N se remplit jusqu'à son dix-huitième électron de
l'yttrium jusqu'au cadmium avant que la couche O ne termine de se remplir de ses huit
électrons avec le xénon.
La sixième période contient 32 éléments. Elle aussi a une double série de transition
qui commence avec le lanthane et se termine avec le mercure. La couche O se remplit de ses
dix-huit électrons.
Notez cependant que cette série se scinde après le lanthane en une série de quatorze
éléments. Dans ces éléments la couche N (troisième à partir de l'extérieur) se
remplit de ses électrons huit jusqu'à trente-deux. Ceux-ci portent le nom de série de
transition interne ou série des lanthanes ou des terres rares. Elle commence avec le
cérium et fini avec le lutécium.
A la suite de quoi, la série de transition débutant avec l'hafnium jusqu'au mercure
finit de construire la couche O jusqu'au dix-huitième électrons. Ensuite la couche P
continue de s'ériger jusqu'à avoir ses huit électrons et se complète avec le radon.
La septième période est incomplète. Les deux premiers éléments: le francium et le
radium remplisse la couche Q de deux électrons. Ensuite les couches P et O se remplissent
de la mème façon que la sixième période. Ce qui donne la série des actinides.
Sous-couches Électroniques
Chaque couche électronique, que l'on désigne par les lettres K, L, M, N, O, P, et Q ou
par les numéros 1, 2, 3, 4, 5, 6, et 7, se subdivise à nouveau en sous-couches.
La première couche principale, la couche K , a une seule sous-couche appelée la couche
1s .La deuxième couche principale, la couche L, a deux sous-couches appelées 2s et 2p.
La troisième couche principale, la couche M, a trois sous-couches appelées: 3s, 3p, et
3d. La quatrième couche principale, la couche N , a quatre sous-couches appelées: 4s,
4p, 4d, et 4f
.
Les sous-couches se subdivisent à leur tour en orbitales, chacune pouvant contenir un
maximum de deux électrons. Ainsi, la sous-couche s , qui n'est constituée que d'une
seule orbitale, ne peut contenir que deux électrons. Une sous-couche p qui a trois
orbitales peut contenir six électrons. Une sous-couche d possède cinq orbitales et peut
contenir dix électrons. Une sous-couche f a sept orbitales et peut de la sorte contenir
quatorze électrons.
De façon générale, un électron s s'approchera davantage du noyau qu'un électron p
appartenant à la même couche principale; un électron p sera plus près du noyau qu'un
électron d et un électron d sera lui-aussi plus près qu'un électron f.
La façon de décrire la structure électronique consiste à indiquer le numéro de la
couche principale en premier suivie de la lettre correspondant à la sous-couche et un
chiffre en exposant qui indique le numéro de l'électron de cette sous-couche
particulière. Par exemple 3d4 indique qu'il y a quatre électrons dans la sous-couche d
de la couche principale M .
Forme des Orbitales Électroniques
Les orbitales occupées par les électrons dans les différentes sous-couches sont
différentes les unes des autres tant par la grosseur, par la forme et par l'orientation
dans l'espace. Plus le numéro de la couche principale est grand, plus le volume de
l'orbitale correspondante sera grand.
Par exemple un électron 2s occupe une orbitale plus volumineuse qu'un électron dans une
orbitale 1s. Cependant, les orbitales des couches principales plus élevées excèdent
celles des couches plus basses. Ce qui veut dire que les électrons périphériques
pénètrent à l'intérieure des régions occupées par les électrons des couches
internes.
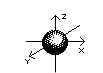
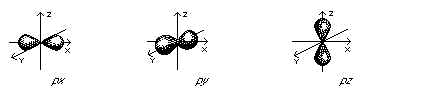
La forme d'une orbitale s est celle d'une sphère alors qu'une orbitale p rappelle plutôt
celle d'une haltère ou de deux lobes séparés par une zone de probabilité nulle.
Le nombre d'orientations possibles dans l'espace des orbitales atomiques dépend jusqu'à
un certain point de la forme de l'orbitale. Une orbitale s présente la même apparence à
un observateur externe puisque sa forme est sphérique. De sorte que l'orbitale s possède
une symétrie sphérique et n'a pas de caractéristiques directionnelles.

Orbitales s
C'est un peu plus compliqué avec les orbitales p qui sont par groupe de trois. Il n'est
pas possible de déterminer la direction d'une orbitale en particulier dans un groupe
donné. Cependant les axes sur lesquelles sont disposés les trois orbitales p sont
perpendiculaires les uns par rapport aux autres. Les trois orbitales p sont appelés px,
py et pz pour mettre en évidence leur nature directionnelle.
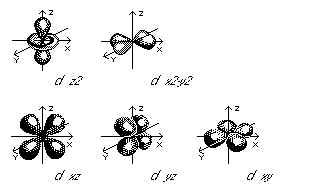
Les cinq orbitales d ont la forme de régions lobées disposées dans l'espace comme on
peut le voir ci-dessous. Les dessins sont orientés de sorte que les lobes des orbitales
dz2 et dx2-y2 sont disposées le long des axes et les lobes des orbitales dxz, dyz, et dxy
sont entre les axes.
Les orbitales d existent sous deux formes de base: quatre des cinq orbitales 3d ont quatre
lobes orientés selon le plan des axes indiqués (dyz, dxz, dxy et dx2-y2). La cinquième
orbitale, dz2,elle a une forme particulière: deux lobes sont orientés selon l'axe z de
part et d'autre d'un anneau situé dans le plan xy. Les orbitales d de niveau supérieur
à trois ressemblent à celles du niveau 3, mais elles sont plus volumineuses.
Les sept orbitales f apparaissent à partir de la couche quatre (du niveau n=4) et leurs
formes sont encore plus complexes que celles des orbitales d. On ne les mentionne ici que
pour compléter le tableau descriptif des orbitales.